L’avanzamento tecnologico del mondo contemporaneo ha permesso di applicare allo studio della mente alcune metodiche d’indagine che sarebbero apparse fantascientifiche solo pochi decenni fa. Tra queste metodiche vi è sicuramente la “risonanza magnetica” ed in questo articolo cerco di mettere in luce alcuni elementi che possano far comprendere qual è lo stato attuale della ricerca scientifica in quest’ambito. Innanzitutto, la risonanza magnetica è una metodica che permette di visualizzare il cervello in vivo. Questa semplice espressione, in vivo, porta in sé una rivoluzione che ha determinato un impressionante salto qualitativo rispetto ai metodi disponibili nella neurologia classica, come ad esempio il metodo di correlazione anatomo-funzionale post-mortem. Questo consisteva nell’attendere, una volta classificato un dato paziente in termini di deficit cognitivo, anni e forse decenni per eseguire un esame cerebrale post-mortem, così da poter mettere in relazione (correlare appunto) quella determinata disfunzione con una specifica area o insieme di area risultate danneggiate dall’esame post-mortem. Sebbene tale approccio abbia contribuito a chiarire alcuni meccanismi fondamentali del funzionamento cerebrale, appaiono subito anche evidenti ovvie limitazioni, legate principalmente al tempo intercorso tra la rilevazione del deficit e l’esame post-mortem, che ovviamente poteva portare all’insorgenza di altri deficit e fattori tali da rendere assai più complessa l’interpretazione della relazione anatomo-funzionale.
Non c’è quindi da stupirsi se la possibilità di esaminare un cervello in vivo, e cioè appena rilevato il deficit e senza la necessità di attendere un esame post-mortem, abbia portato ad un significativo incremento delle nostre conoscenze sul funzionamento cerebrale. Oltre a permettere una dettagliata visualizzazione di eventuali lesioni e danni cerebrali (risonanza magnetica “strutturale”) queste tecnologie permettono anche di comprendere il funzionamento del cervello (risonanza magnetica “funzionale”), misurando la cosiddetta attività emodinamica cerebrale durante lo svolgimento di un compito cognitivo. È bene sapere che l’attività emodinamica consiste in una misura indiretta del funzionamento cerebrale (Mangia et al., 2009): nel momento in cui un determinato insieme di cellule cerebrali diviene più attivo perché coinvolto nell’esecuzione di un compito, così come un atleta durante lo svolgimento di una competizione, necessita maggiori risorse ed in particolare maggiore apporto di ossigeno e di zuccheri (glucosio). Ossigeno e zuccheri vengono trasportati nel flusso ematico, che aumenterà selettivamente proprio in corrispondenza di quelle aree cerebrali costituite dalle cellule attive durante quel dato compito cognitivo. Per alcune aree del cervello si assiste quindi ad un incremento selettivo di attività emodinamica ed è proprio questo che viene rilevato dalla risonanza magnetica funzionale (Sacco, 2013). Tramite questa tecnologia è stato possibile assistere negli ultimi due decenni ad un rapido sviluppo delle cosiddette neuroscienze cognitive, il cui obiettivo è appunto quello di comprendere i correlati neurali dei molti processi mentali e cognitivi, e cioè l’area o l’insieme di aree cerebrali coinvolte nel processo. Questo non vuol dire, tuttavia, che il funzionamento cerebrale sia stato del tutto compreso, anzi. I ricercatori che operano in questo campo sono ben coscienti di quanto ci sia ancora da scoprire e di quanto ciascun approccio e metodica sperimentale, per quanto tecnologicamente avanzata, porti con sé anche dei limiti dei quali bisogna esser ben coscienti.
A volte invece, quando assistiamo alla divulgazione su articoli di giornale di risultati scientifici ottenuti tramite metodiche di neuroimmagini – strutturali o funzionali che siano – ci troviamo di fronte a delle descrizioni poco dettagliate e soprattutto poco critiche rispetto al come quei risultati sono stati ottenuti. Le conseguenze di questo sono ben esemplificate da uno studio che mostra come tipicamente i risultati scientifici accompagnati da “neuroimmagini” (e cioè immagini cerebrali) siano ritenute più affidabili. McCabe & Castel (2008) hanno chiesto ad un ampio numero di soggetti (studenti universitari) di valutare la credibilità e l’affidabilità di alcuni risultati scientifici che potevano essere accompagnati da un semplice grafico a barre, da neuroimmagini con attivazioni cerebrali, o da nessuna immagine. I risultati di questo studio mostrano valutazioni significativamente più alta in termini di valore scientifico quando i risultati erano accompagnati da neuroimmagini, mostrando una sorta di effetto di “neurorealismo” (Sacco, 2013). McCabe & Castel interpretano la fascinazione data dalle neuroimmagini come il risultato della presentazione di una base fisica e concreta che porta ad una spiegazione riduzionistica (e quindi semplificata) del processo cognitivo, che è per sua natura invece un fenomeno “astratto” e di difficile comprensione.
Lo studio di McCabe & Castel (2008) fa comprendere quanto le neuroimmagini possano far presa sull’immaginario collettivo. Proprio per questo è necessario essere cauti nelle conclusioni a cui si pensa di giungere con tale metodica e consapevoli dei limiti attuali in cui ci muove. Nel presente articolo cerco di mettere in luce tre importanti limitazioni che si tende a non considerare quando si riportano i risultati derivanti da studi di neuroimmagini, così da favorire auspicabilmente la qualità della divulgazione scientifica. Tali limitazioni riguardano l’uso del cosiddetto “modello generale lineare”, i limiti intrinseci di ciò che viene definito come “approccio sottrattivo”, e non ultimo il fatto che la messa in relazione tra area e processo mentale non equivale ad un vincolo causale.
Uso del “modello generale lineare”
Limiti intrinseci dell’approccio sottrattivo
Precedentemente ho descritto a livello esemplificativo un piccolo esperimento che tuttavia risulterebbe troppo semplicistico per approdare a dei risultati concreti. Complichiamolo un pochino! Bisogna infatti considerare che durante un qualsiasi esperimento il soggetto è “vivo”, e, in quanto tale, oltre che seguire le istruzioni data dallo sperimentatore, in questo caso premere un tasto di risposta ogni volta che compare un volto sullo schermo, non smette di seguire i suoi flussi di pensieri, immaginando, ad esempio, cosa farà al termine dell’esperimento o agli impegni che ha per i giorni seguenti, oppure ricordando e riflettendo su episodi passati della sua vita, e quant’altro. Dal punto di vista delle attivazioni cerebrali, la concomitanza di tutti questi possibili processi si tradurrebbe nell’attivazione dell’intero encefalo se non usassimo una cosiddetta “condizione di controllo”, una condizione che varia da quella sperimentale (o di interesse) solo per un elemento critico, e per la quale si assume ci sia la stessa variabilità legata al “rumore”, cioè al fatto che il soggetto segue il suo flusso di pensieri. Ad esempio, una possibile condizione di controllo del nostro esperimento potrebbe essere la presentazione di immagini che illustrano utensili (martello, cacciavite, chiave inglese, ecc.). Quindi avremmo una condizione sperimentale costituita da immagini di volti umani ed una condizione di controllo costituita da immagini di utensili. Tali immagini (sperimentali e di controllo) verrebbero presentate alternate in modo casuale così da evitare abituazione e prevedibilità nel soggetto, al quale viene sempre chiesto di segnalare la presenza del volto umano tramite pressione del tasto di risposta. La presenza della condizione di controllo sarà fondamentale a livello di analisi dei dati di neuroimmagini funzionali, che si baseranno su un approccio sottrattivo. Infatti, all’attività emodinamica cerebrale corrispondente alla presentazione dei volti verrà “sottratta” l’attività emodinamica corrispondente alla presentazione degli utensili. Questo permetterà di “rimuovere” (o sottrarre, appunto) tutta la variabilità cerebrale legata al “seguire il proprio flusso di pensieri” durante lo svolgimento dell’esperimento, che si assume sia comparabile tra le due condizioni, lasciando solo l’area o le aree deputate all’elaborazione dei volti (se fossimo invece interessati alle aree che elaborano la categoria semantica utensili allora potremmo eseguire la sottrazione opposta, e cioè visione di utensili “meno” visione di volti). Questo approccio è molto efficace nel perseguire la cosiddetta “specializzazione funzionale” che per definizione porta ad evidenziare in quali processi siano coinvolte singole aree. Tuttavia sempre più evidenze portano a ritenere che anche le attività mentali più semplici si basino su di un’attivazione concertata di reti di aree cerebrali (Raichle, 2015b), e quindi oggi la frontiera più avanzata tende a muoversi dalla specializzazione alla “integrazione” funzionale, cercando di comprendere come più aree dialoghino fra loro per supportare la messa in atto di un processo cognitivo (Raichle, 2015b).
Correlazione non è sinonimo di causazione
Indipendentemente dal fatto che si stia utilizzando un approccio di specializzazione o di integrazione funzionale, quello che molto spesso si tende a concludere in maniera erronea e sbrigativa è che quella determinata aree o circuito di aree trovate attive siano responsabili della messa in atto di quella funziona cognitiva. Per tornare al nostro esempio relativo alla percezione dei volti umani, è molto probabile che i risultati mettano in luce l’attivazione del giro fusiforme, un’area ormai nota in letteratura per l’elaborazione dei volti umani, tanto da esser definita come l’area fusiforme per i volti (dall’inglese, fusiform face area, FFA; vedere Fig. 1 e Kanwisher e Yovel, 2006).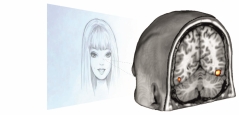 Se facendo “visione volti” meno “visione utensili” (vedere paragrafo precedente) trovassimo un incremento selettivo di attività emodinamica nella FFA potremmo essere tentati di concludere che l’aumento di attività in quest’area sia la “causa” della nostra capacità di riconoscere volti umani. Questa conclusione sarebbe tuttavia errata in quanto quello che evidenziano i dati è una semplice concomitanza dell’incremento di attivazione della FFA con la presentazione di volti umani. Questa distinzione può sembrare sottile ma è quello che differenzia un vincolo causale da una semplice correlazione di eventi. E allora, come si giunge veramente a definire il ruolo determinante di una regione cerebrale, nel nostro esempio l’area fusiforme per i volti, nello svolgimento di un processo mentale? Beh, semplicemente ammettendo che nessuna tecnica, per quanto avanzata, è in grado di fornire prove univoche da sola, e quindi integrando i risultati di neuroimmagini funzionali, per loro natura correlazionali, con altre tecniche che permettono più facilmente di stabilire vincoli causali. Una tecnica d’indagine da cui si possono ricavare informazioni di natura causale è la stimolazione transcranica magnetica (TMS), a dispetto del nome del tutto indolore e non invasiva (Rossini e Rossi, 2007). La TMS permette di erogare un impulso magnetico in grado di interferire temporaneamente con l’attività di specifiche aree cerebrali. Restando all’interno del nostro esempio sperimentale, provocare un deficit transitorio della FFA potrebbe permettere di dimostrare la sua implicazione causale rispetto all’elaborazione dei volti: se interrompendo l’attività della FFA provoco un deficit transitorio nel riconoscimento di volti (quello che in ambito neuropsicologico è noto come prosopagnosia) allora posso davvero concludere che l’attività della FFA sia in grado di determinare (o “causare”) la nostra capacità di riconoscere i volti (cioè, no FFA = no riconoscimento).
Se facendo “visione volti” meno “visione utensili” (vedere paragrafo precedente) trovassimo un incremento selettivo di attività emodinamica nella FFA potremmo essere tentati di concludere che l’aumento di attività in quest’area sia la “causa” della nostra capacità di riconoscere volti umani. Questa conclusione sarebbe tuttavia errata in quanto quello che evidenziano i dati è una semplice concomitanza dell’incremento di attivazione della FFA con la presentazione di volti umani. Questa distinzione può sembrare sottile ma è quello che differenzia un vincolo causale da una semplice correlazione di eventi. E allora, come si giunge veramente a definire il ruolo determinante di una regione cerebrale, nel nostro esempio l’area fusiforme per i volti, nello svolgimento di un processo mentale? Beh, semplicemente ammettendo che nessuna tecnica, per quanto avanzata, è in grado di fornire prove univoche da sola, e quindi integrando i risultati di neuroimmagini funzionali, per loro natura correlazionali, con altre tecniche che permettono più facilmente di stabilire vincoli causali. Una tecnica d’indagine da cui si possono ricavare informazioni di natura causale è la stimolazione transcranica magnetica (TMS), a dispetto del nome del tutto indolore e non invasiva (Rossini e Rossi, 2007). La TMS permette di erogare un impulso magnetico in grado di interferire temporaneamente con l’attività di specifiche aree cerebrali. Restando all’interno del nostro esempio sperimentale, provocare un deficit transitorio della FFA potrebbe permettere di dimostrare la sua implicazione causale rispetto all’elaborazione dei volti: se interrompendo l’attività della FFA provoco un deficit transitorio nel riconoscimento di volti (quello che in ambito neuropsicologico è noto come prosopagnosia) allora posso davvero concludere che l’attività della FFA sia in grado di determinare (o “causare”) la nostra capacità di riconoscere i volti (cioè, no FFA = no riconoscimento).
Conclusioni
Il progresso tecnologico può portare con sé una sorta di adesione fideistica (Vacca, 1995), per cui tutto ciò che è tecnologico è di per sé dotato di un elevato grado di certezza e affidabilità, laddove invece la scienza è sempre estremamente parsimoniosa nel dare un dato per acquisito. Vedere le neuroimmagini come un metodo pressoché infallibile per indagare i processi mentali è purtroppo al momento ben lontano dalla realtà dei fatti (e questo lo dico da ricercatore che opera nel mondo delle neuroimmagini, e non certo da detrattore). In questo breve articolo ho voluto delineare alcuni limiti generali noti da tempo nella comunità scientifica che raramente arrivano ai non addetti ai lavori quando si fa divulgazione dei risultati ottenuti con le tecniche di visualizzazione cerebrale. Essere coscienti dei limiti attuali delle neuroimmagini è l’unico modo per spingersi oltre, verso lo sviluppo di metodiche ancora più potenti al fine di cogliere l’estrema complessità del funzionamento cerebrale umano.
Bibliografia
Duffy, E. (1957). The psychological significance of the concept of "arousal" or "activation". Psychological Review, 64, 265-275.
Mangia, S., Giove, F., Tkác, I., Logothetis, N. K., Henry, P. G., Olman, C. A., et al. (2009). Metabolic and hemodynamic events after changes in neuronal activity: Current hypotheses, theoretical predictions and in vivo NMR experimental findings. Journal of Cerebral Blood Flow and Metabolism, 29, 441-463.
McCabe, D. P., & Castel, A. D. (2008). Seeing is believing: The effect of brain images on judgments of scientific reasoning. Cognition, 107, 343-352.
Friston, K. J., Holmes, A. P., Worsley, K. J., Poline, J. B., Frith, C., & Frackowiak, R. S. J. (1995). Statistical Parametric Maps in Functional Imaging: A General Linear Approach. Human Brain Mapping, 2, 189-210.
Kanwisher, N., & Yovel, G. (2006). The fusiform face area: A cortical region specialized for the perception of faces. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 361, 2109-2128.
Raichle, M. E. (2015a). The brain's default mode network. Annual Review of Neuroscience, 38, 433-447.
Raichle, M. E. (2015b). The restless brain: How intrinsic activity organizes brain function. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 370(1668).
Rossini, P. M., & Rossi S. (2007). Transcranial magnetic stimulation: Diagnostic, therapeutic, and research potential. Neurology, 68, 484-488.
Sacco, K. (2013). Le neuroimmagini: Nuove frontiere per lo studio del cervello umano in vivo. Napoli: Idelson Gnocchi.
Vacca, R. (1995). Il medioevo prossimo venturo. Milano: Mondadori.
Glossario



